Περιεχόμενο
- στάδια
- Μέθοδος 1 Μάθετε τους κανόνες της διαλυτότητας
- Μέθοδος 2 Χρησιμοποιήστε ένα μνημονικό: NAG SAG
- Μέθοδος 3 Τα βασικά της μάθησης
Η διαλυτότητα μιας ένωσης είναι η ικανότητά της να διαλύεται σε νερό. Μία αδιάλυτη ένωση θα σχηματίσει ένα ίζημα σε διάλυμα. Μια μερικώς διαλυτή ένωση λέγεται επίσης ότι είναι χημικώς αδιάλυτη. Αν θυμάστε τους κανόνες της διαλυτότητας, θα κάνει τη ζωή σας πιο εύκολη όταν πρέπει να εργαστείτε με χημικές εξισώσεις. Με λίγο χρόνο, εργασία και μερικά μνημονικά κόλπα, θα θυμηθείτε όλους τους τύπους.
στάδια
Μέθοδος 1 Μάθετε τους κανόνες της διαλυτότητας
-

Τα άλατα της Ομάδας ΙΑ είναι διαλυτά. Ο περιοδικός πίνακας στοιχείων οργανώνεται σε σειρές και στήλες που ονομάζονται "περιόδους" και "ομάδες" αντίστοιχα. Η πρώτη στήλη του πίνακα περιέχει τα στοιχεία της ομάδας 1Α. Είναι αλκαλικά μέταλλα. Αυτά περιλαμβάνουν τα στοιχεία Li, Na, K, Cs και Rb.- Παράδειγμα: Τα KCl και LiOH είναι διαλυτά στο νερό.
-

Τα άλατα νιτρικών, χλωρικών και οξεικών είναι διαλυτά. Όταν χρησιμοποιούνται νιτρικά άλατα (του τύπου ΝΟ3), χλωρικό (ClO τύπο3) ή λακτάτη (του τύπου CH3COO) σχηματίζουν άλατα, καθίστανται διαλυτά στο νερό.- Παράδειγμα: KNO3, NaClO3 και CH3Τα COONa είναι όλα διαλυτά.
-

Όλα τα άλατα αμμωνίου είναι διαλυτά. Λιοντάρι αμμωνίου (τύπος ΝΗ4) σχηματίζει άλατα που διαχωρίζονται πλήρως στο νερό. Δεν υπάρχει εξαίρεση σε αυτόν τον κανόνα.- Παράδειγμα: NH4Το ΟΗ είναι διαλυτό ακόμη και αν περιέχει ιόν υδροξειδίου.
-
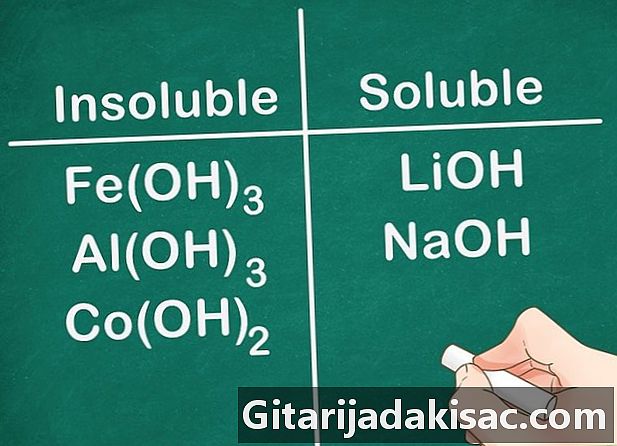
Οι περισσότερες υδροξυλικές ενώσεις είναι αδιάλυτες. Ορισμένα άλατα υδροξειδίου είναι ελαφρώς διαλυτά. Αυτή είναι η περίπτωση των υδροξειδίων που σχηματίζονται με τα στοιχεία της ομάδας 2 (Ca, Sr και Ba). Τα άλατα υδροξειδίου που σχηματίζονται με τα στοιχεία της Ομάδας 1 αποτελούν εξαίρεση επειδή αυτά τα στοιχεία είναι ακόμα διαλυτά.- Παράδειγμα: Fe (ΟΗ)3, ΑΙ (ΟΗ)3 και Co (ΟΗ)2 είναι αδιάλυτες, αλλά το LiOH και το NaOH είναι διαλυτά.
-

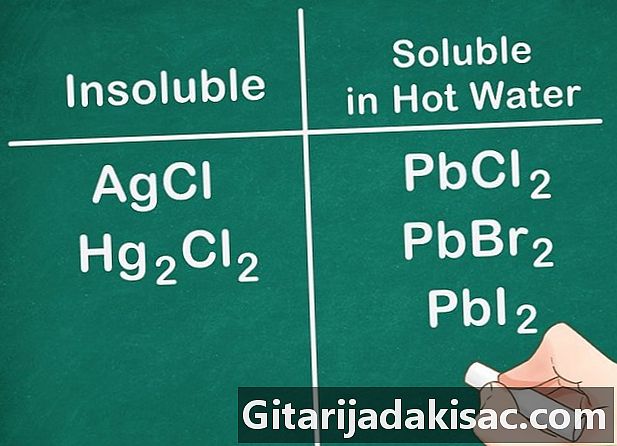
Τα μη μεταλλικά άλατα της ομάδας 17 είναι γενικά διαλυτά. Τα μη μεταλλικά ομάδας 17 περιλαμβάνουν το χλώριο (Cl), το βρωμίδιο (Βγ) και το λίθο (Ι). Τα χρήματα, το μόλυβδο και ο υδράργυρος είναι εξαιρέσεις σε αυτόν τον κανόνα. Οι ενώσεις που αποτελούνται από αυτά τα μη-μέταλλα και αυτά τα ιόντα δεν είναι διαλυτά.- Παράδειγμα: AgCl και Hg2Cl2 είναι αμφότερα αδιάλυτα.
- PbCl2, PbBr2 και PbI2 είναι διαλυτά σε πολύ πυκνό νερό.
-
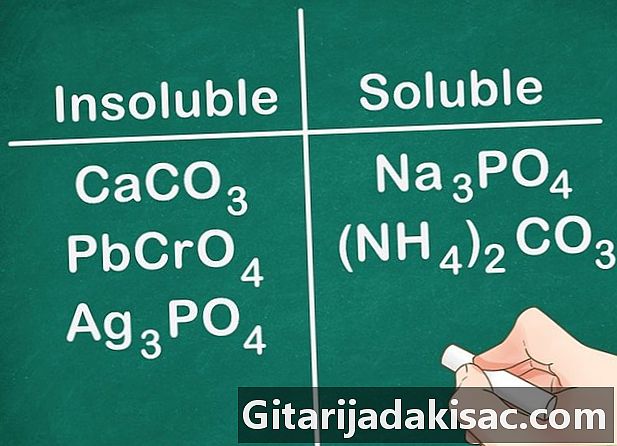
Τα περισσότερα ανθρακικά, χρωμικά και φωσφορικά άλατα είναι αδιάλυτα. Οι χημικοί τύποι για τα στοιχεία αυτά είναι: CO3 (ανθρακικά άλατα), CrO4 (χρωμικά) και ΡΟ4 (Φωσφορικά άλατα). Μέταλλα ομάδας 1Α και ενώσεις NH4 εξαίρεση και είναι διαλυτές.- Παράδειγμα: ενώσεις όπως το CaCO3, PbCrO4 και Ag3PO4 όλα είναι αδιάλυτα ενώ ενώσεις όπως Na3PO4 και (ΝΗ4)2CO3 είναι διαλυτά.
-
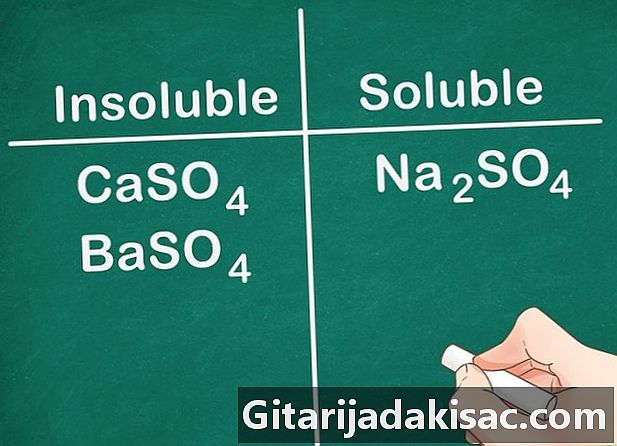
Τα περισσότερα από τα θειικά άλατα είναι διαλυτά. Τα περισσότερα άλατα συμπεριλαμβανομένου ενός ιόντος SO4 είναι διαλυτό στο νερό. Τα Ca, Ba, Pb, Ag, Sr και Hg είναι εξαιρέσεις σε αυτόν τον κανόνα. Τα θειικά άλατα που περιέχουν αυτά τα ιόντα δεν είναι διαλυτά.- Παράδειγμα: Na2SO4 είναι πλήρως διαλυτό ενώ το CaSO4 και BaSO4 δεν είναι διαλυτά.
-

Η πλειονότητα των ενώσεων θείου είναι αδιάλυτη στο νερό. Το βαρίου, το ασβέστιο, το μαγνήσιο, το νάτριο, το κάλιο και το αμμώνιο αποτελούν εξαιρέσεις σε αυτόν τον κανόνα. Μόνο οι ενώσεις που κατασκευάζονται από αυτά τα στοιχεία και το θειούχο είναι διαλυτές στο νερό.- Παράδειγμα: Τα CdS, FeS και ZnS είναι όλα αδιάλυτα.
- Ωστόσο, τα σουλφίδια μετάλλων μετάπτωσης είναι αδιάλυτα.
Μέθοδος 2 Χρησιμοποιήστε ένα μνημονικό: NAG SAG
-

Χρησιμοποιήστε το μνημονικό NAG SAG μνημονικό. Το Lacronyme NAG SAG είναι ένα εύκολο τέχνασμα για να θυμόμαστε διαλυτές ενώσεις και εξαιρέσεις. Γράψτε το όνομα NAG SAG και απομνημονεύστε τη σημασία κάθε γράμματος. Αυτή η τεχνική δεν αποκλείει όλους τους κανόνες διαλυτότητας, αλλά καλύπτει ένα μεγάλο μέρος αυτών. Όλα τα γράμματα αντιπροσωπεύουν διαλυτά μόρια.- Ν: Νιτρικά (NO3)
- Α: Οξεικά (CH3COO)
- G: αλκαλικά μέταλλα της ομάδας 1 (Li, Na, κ.λπ.)
- S: Θειικά (SO4)
- Α: Ιόντα αμμωνίου (ΝΗ4)
- G: μη μέταλλα της ομάδας 17 (F, CI, Br, I, κ.λπ.)
-

Θυμηθείτε το όνομα PMA για την πρώτη εξαίρεση. Το Ρ παριστά το Pb (μόλυβδος). Το Μ αντιπροσωπεύει τον υδράργυρο (Hg2). Το Α αντιπροσωπεύει αργύριο (Ag). Αυτά τα τρία ιόντα δεν είναι ποτέ διαλυτά με τη θειική ομάδα ή τα μη-μέταλλα της ομάδας 17.- Όταν σημειώνετε το μνημονικό τέχνασμα, σχεδιάστε ένα αστέρι κοντά στο ακρωνύμιο PMA και ένα παρόμοιο αστέρι κοντά στο S και το G της SAG για να σας υπενθυμίσουμε ότι πρόκειται για εξαιρέσεις.
-

Θυμηθείτε τις λέξεις "Castro" και "bar" για τη δεύτερη εξαίρεση. Μπορεί να ακούγεται ηλίθιο, αλλά αυτές οι λέξεις θα σας βοηθήσουν να θυμηθείτε τα ιόντα ασβεστίου (Ca, strontium (Sr) και βαρίου (Ba).) Αυτά τα τρία ιόντα δεν είναι ποτέ διαλυτά με θειικά άλατα.- Κάντε ένα σταυρό δίπλα σε αυτά τα λόγια και ένα άλλο σταυρό κοντά στο S της SAG για να θυμάστε ότι αυτά τα ιόντα είναι οι εξαιρέσεις για τη διαλυτότητα του θειικού άλατος.
Μέθοδος 3 Τα βασικά της μάθησης
-

Επανεξέταση συχνά. Η ανάμνηση των πληροφοριών απαιτεί πάντα χρόνο και εργασία. Όσο περισσότερο διαβάζετε τα μαθήματά σας, τόσο περισσότερο θα θυμάστε μακροπρόθεσμα. Ελέγχετε συχνά τους κανόνες και δοκιμάστε τον εαυτό σας καθημερινά για το θέμα.- Ζητήστε από τους φίλους ή την οικογένειά σας να σας υποβάλουν ερωτήσεις σχετικά με αυτό το θέμα κατά τη διάρκεια του γεύματος ή του δείπνου
- Κρατήστε ένα αντίγραφο των κανόνων στο χέρι για έλεγχο όταν έχετε κάποιο ελεύθερο χρόνο.
-

Δημιουργήστε σύνολα και χρησιμοποιήστε τα. Οι κάρτες είναι ένα εξαιρετικό μέσο για να αναθεωρήσετε γρήγορα ένα θέμα και να το απομνημονεύσετε. Σημειώστε τους κανόνες διαλυτότητας σε κάρτες με μερικά παραδείγματα. Ελέγξτε τα φύλλα μέχρι να εξοικειωθείτε με τους κανόνες και τα ονόματα των ενώσεων που είναι διαλυτές και αδιάλυτες.- Πάρτε τις κάρτες σας μαζί σας και τις βγάζετε για να τις αναθεωρήσετε στο αυτοκίνητο ή όταν περιμένετε τους φίλους σας.
- Όλες οι ευκαιρίες είναι καλές να ελέγξετε τις καταχωρίσεις σας.
-

Χρησιμοποιήστε μνημονικά μέσα. Τα mnemonic εργαλεία είναι συμβουλές για να σας βοηθήσουν να απομνημονεύσετε τις πληροφορίες γρήγορα και εύκολα. Όταν μαθαίνετε έναν μνημονικό όρο, ίσως είναι χρήσιμο να το γράψετε πολλές φορές για να το θυμάστε. Τα μνημονικά κόλπα είναι χρήσιμα μόνο αν ξέρετε τι σημαίνει κάθε γράμμα!- Πρακτική γράφοντας τα ακρωνύμια και τι σημαίνει κάθε γράμμα.
- Όταν εξετάζετε, σημειώστε πρώτα τις μνημονικές συμβουλές για μελλοντική αναφορά.